近日,北京市科学技术委员会、中关村科技园区管理委员会、北京市发展和改革委员会等五大部门联合公示了2023年度第一批(总第十八批)北京市新技术新产品(服务)名单。凭借领先的技术能力、产品创新能力及质量可靠性等优势,求臻医学自主设计研发的“ChosenOne®MRD基因检测服务”获北京市新技术新产品(服务)认定证书。

北京市新技术新产品(服务)认定具有极高权威性,以“创新性、技术先进、质量可靠、产权明晰、市场前景广阔”为评定标准,旨在鼓励和支持创新,推动新技术新产品(服务)应用和民生改善,提升全社会自主创新能力。
针对早期患者的术后复发监测,MRD检测能先于影像学预测复发,评估预后;而对于中晚期患者化疗、靶向、免疫用药,MRD可以进行疗效评估,辅助治疗决策。求臻医学ChosenOne®MRD基因检测基于以上背景产生,1.0版检测产品于2021年底正式上线,并于2023年初首创性提出固定化+定制化Panel AI双驱动策略,其服务的技术原理及创新点获得北京市科学技术委员会等认可。
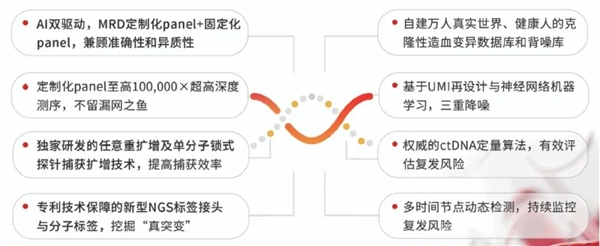
图1.ChosenPace®MRD技术亮点
一路走来,经过近2年的产品迭代升级及临床应用实践,该产品已获得4项发明专利授权及4项软件著作权,让众多肿瘤患者获益。近期,国内首个《胃癌分子残留病灶检测与临床应用中国专家共识(2023版)》见刊,填补了胃癌MRD检测与临床应用规范空白。求臻医学作为肿瘤NGS领域唯一参与企业,其研发团队为推进本共识的制订提供了全面的技术支持,ChosenOne®MRD检测产品核心技术也获得了该共识引荐。

图2. 求臻医学ChosenOne®MRD拥有知识产权情况
本次获得新技术新产品(服务)认证,是对求臻医学ChosenOne®MRD检测产品核心技术先进性、创新性、服务水平及未来市场前景的再次认可。经认定的新技术新产品(服务),不仅可以获得其在垂直领域的创新成果展示,还可享受政府采购和推广应用等政策支持和资金的扶持,进一步推动科技创新的发展。
目前,求臻医学已有自主研发的8项产品获得北京市新技术新产品(服务)证书,未来,公司将秉承“探索科技创新 致力医学求臻”的企业使命,持续优化产品和服务,为更多肿瘤患者带来切实获益。

图3.求臻医学多项新技术、新产品(服务)荣获该认证

求臻医学自主研发,创造性地打造了ChosenPace®MRD动态监测2.0方案,基于患者肿瘤组织的1123个基因突变情况(基线),筛选定制化Panel(Informed策略),结合肿瘤高发变异的MRD Panel(Agnostic策略),实现AI双驱动策略下的超高深度测序。同时,通过深度学习神经网络对十万人大数据背噪库及克隆性造血数据库训练,实现九重联合置信分析,并定期追踪ctDNA状态,进行MRD的动态监测。
ChosenPace®MRD2.0的基线组织检测在分析DNA水平的同时,还涵盖常见融合基因的RNA表达情况及相关肿瘤的HRD状态,综合评估TMB、MSI、HLA分型等免疫治疗标志物及上百个免疫治疗正负向基因,提供全面准确的个体化诊疗信息,构建了肿瘤“筛、诊、治、监、预后”的完美闭环。
标题:求臻医学MRD产品喜获北京市新技术新产品(服务)证书
地址:http://www.308101616qq.com//dgjj/76078.html






